【中2】化学反応式
単元:化学反応式の作り方

今日は化学反応式の作り方を学習していくよ。
水素と酸素の化合を例に作り方の手順を確認していこう。
まず水素と酸素が化合すると何ができるか知っているかな?
水素と酸素の化合を例に作り方の手順を確認していこう。
まず水素と酸素が化合すると何ができるか知っているかな?

はい!水ができます💡

正解です。
そうしたら最初にその化学変化を下のように物質名の式で表し、それぞれの物質を粒子モデルと化学式で表します。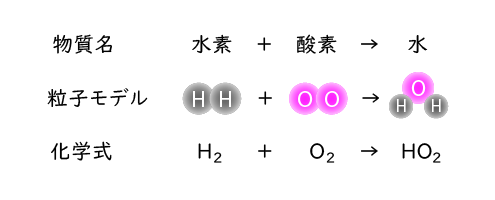
そうしたら最初にその化学変化を下のように物質名の式で表し、それぞれの物質を粒子モデルと化学式で表します。


なるほど。
では水素(H2)・酸素(O2)・水(H2O)の化学式はそれぞれ覚えていないといけませんね。
では水素(H2)・酸素(O2)・水(H2O)の化学式はそれぞれ覚えていないといけませんね。

そうですね。中学校でよく使う化学式は「化学式(単体と化合物)」の所で取り上げてていますので、まだ覚えていなかったら見てみて下さい。
では次に、→の左側と右側で同じ種類の原子の数が等しいか確認します。今の状態ですと酸素原子(O)の数が左辺は2個,右辺は1個なので等しくありません。
そこで、左辺と右辺の酸素原子(O)の数をそろえるために、水分子(H2O)を1個増やします。そのとき、増やした後の水分子(H2O)の個数を下のように化学式の左側に書きます。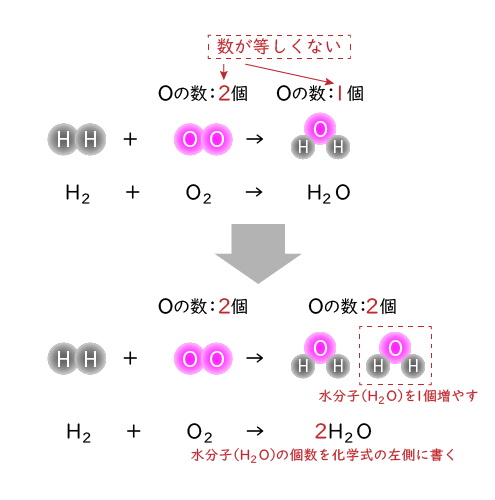
では次に、→の左側と右側で同じ種類の原子の数が等しいか確認します。今の状態ですと酸素原子(O)の数が左辺は2個,右辺は1個なので等しくありません。
そこで、左辺と右辺の酸素原子(O)の数をそろえるために、水分子(H2O)を1個増やします。そのとき、増やした後の水分子(H2O)の個数を下のように化学式の左側に書きます。


なるほど。そうすると酸素原子(O)の数はそろいましたね。ただ今度は水素原子(H)の数が左辺は2個、右辺は4個とそろわなくなってしまいました。
そのため次は、左辺の水素分子(H2)を1個増やせばよさそうです。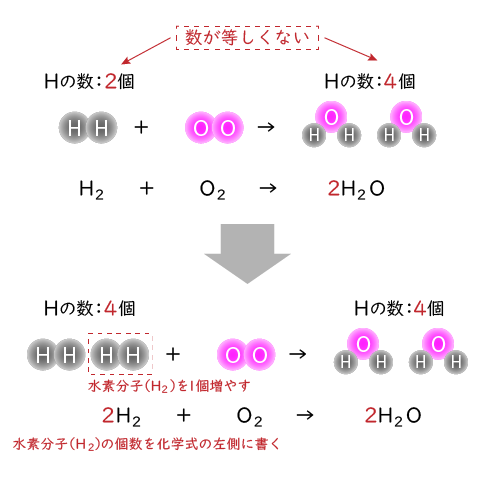
そのため次は、左辺の水素分子(H2)を1個増やせばよさそうです。


正解です。
これで同じ種類の原子の数が左右でそろいましたので、化学反応式の完成です!!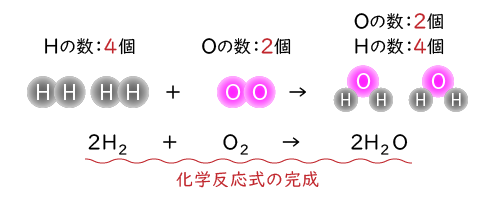 あとは色々な化学反応を化学反応式で書けるように、よく練習しておきましょう。
あとは色々な化学反応を化学反応式で書けるように、よく練習しておきましょう。
下に代表的なものを載せておきますね。
これで同じ種類の原子の数が左右でそろいましたので、化学反応式の完成です!!
 あとは色々な化学反応を化学反応式で書けるように、よく練習しておきましょう。
あとは色々な化学反応を化学反応式で書けるように、よく練習しておきましょう。下に代表的なものを載せておきますね。
代表的な化学反応式
化合
・鉄+硫黄→硫化鉄 Fe+S→FeS
・銅+塩素→塩化銅 Cu+Cl2→CuCl2
・炭素+酸素→二酸化炭素 C+O2→CO2
・水素+酸素→水 2H2+O2→2H2O
・マグネシウム+酸素→酸化マグネシウム 2Mg+O2→2MgO
・銅+酸素→酸化銅 Cu+O2→2CuO
分解
・酸化銀→銀+酸素 2Ag2O→4Ag+O2
・炭酸水素ナトリウム→炭酸ナトリウム+二酸化炭素+水 2NaHCO3→Na₂CO3+CO2+H2O
・塩化銅→銅+塩素 CuCl2→Cu+Cl2
・水→水素+酸素 2H2O→2H2+O2
還元
・酸化銅+炭素→銅+二酸化炭素 2CuO+C→2Cu+CO2
・酸化銅+水素→銅+水 CuO+H2→Cu+H2O
ITTO長野の中学生理科プラン
各プランの内容は現在の学習の状況や志望校などにあわせてご案内しています。詳しくは各教室まで。例えばこんなプランで









